Notícias
Fique por dentro das novidades do Terapia Manual |
| |
Cefaléia cervicogênica: uma perspectiva clínica
T. Hall, K Briffa, D. Hopper. J of Manual & Manipulative Therapy V. 16 2009
Traduzido e adaptado do original T. Hall, K Briffa, D. Hopper. J of Manual & Manipulative Therapy V. 16 2009 preservando os direitos e originalidade autoral. Proibida a cópia ou reprodução total ou parcial.
INTRODUÇÃO
Dor de cabeça é a desordem de dor mais prevalente, afetando 66% da população global (1), e assim isto representa um problema de saúde importante, perturbando tanto a qualidade de vida e a produtividade no trabalho (2,3). Foi informado em 1999 que no EUA apenas, a enxaqueca custou aos empregadores americanos mais de $ US13 bilhão por ano por causa de dias de trabalho perdidos ou prejudicou a função no trabalho (4). A International Headache Society (IHS) (5) classificou as dores de cabeça como primário, onde não há nenhum outro fator causativo, ou secundário, onde a dor de cabeça acontece em relação temporal íntima a outra desordem para a qual é atribuído. Uma lista de 14 formas de dor de cabeça diferentes foi documentada pela IHS (5). Outras sub-classificações são possíveis; por exemplo, enxaqueca pode ser sub-classificada como enxaqueca com ou sem aura, e por sua vez até mesmo mais sub-classificada. Já que cada forma de dor de cabeça tem uma base patológica diferente e o diagnóstico diferencial incorreto vai geralmente levar ao fracasso do tratamento, é crítico diagnostica corretamente o tipo de dor de cabeça. Isto é de importância particular para as intervenções de terapia manuais já que estas são improváveis de serem efetivas para a maioria de formas de dor de cabeça. Também deveria ser notado que formas diferentes de dor de cabeça podem co-existir (6), apresentando ainda mais um desafio para o diagnóstico diferencial.
A forma mais comum de dor de cabeça é dor de cabeça tensional com uma prevalência global de 38% (1), sendo que a enxaqueca tem uma prevalência de 10% (1), dor de cabeça crônica diária 3% (1) e CCG 2,5 a 4,1% (7,8). Porém, prevalência só não provê um quadro completo da incapacidade associado às formas diferentes de dor de cabeça, já que não inclui fatores como a freqüência de ataques e intensidade dos sintomas. Embora a prevalência de CCG é consideravelmente abaixo que dor de cabeça tensional e a enxaqueca, os pacientes com CCG têm um impedimento significante em sua qualidade de vida, quando comparado a outras cefaléias.
Não são bem compreendidos os mecanismos fisiopatológicos subjacentes de muitas das classificações de dor de cabeça. Em termos de avaliação por pesquisas, a enxaqueca recebeu a maior atenção e se acredita envolver uma função cerebral anormal (10), mas a fisiopatologia ainda não é claramente definida (11).
A CCG surge principalmente de disfunção musculoesquelética nos três segmentos cervicais superiores (12). O caminho pelo qual uma dor que se origina no pescoço pode ser sentida na cabeça é o núcleo trigeminocervical (Figura 1) que desce na medula ao nível de C3/4 e está em continuidade anatômica e funcional com as colunas cinzas dorsais destes segmentos espinhais 13. Conseqüentemente, o input de aferentes sensitivos principalmente de quaisquer das três raízes nervosas cervicais superiores podem erroneamenteserem sentidos como dor na cabeça (12), um conceito conhecido como convergência.
Os terapeutas manuais têm por algum tempo tratado a coluna cervical com o objetivo de aliviar dor de cabeça (14), mas só é recentemente que os investigadores avaliaram a efetividade de tal intervenção para as desordens de dor de cabeça específicas. Por exemplo, Jull et al (15), em um estudo randomizado controlado de qualidade metodológica alta, mostraram que a terapia manual era uma forma efetiva de manejo para a CCG. Além disso, Bronfort et al (16) revisaram as evidências para tratamentos físicos não invasivos para cinco tipos de dor de cabeça inclusive "enxaqueca", "tensional", "CCG", uma mistura de "enxaqueca e tensional", e dor de cabeça "pós-traumática." Eles acharam evidência que tanto o exercício cervical (treinamento de resistência de baixa-intensidade) e manipulação espinhal eram efetivas dentro de curto e longo prazo para a CCG. Em contraste, a revisão deles não apoiou o uso de terapia manual para o manejo a longo prazo da enxaqueca ou outras formas de dor de cabeça. Revisões semelhantes chegaram às mesmas conclusões para o tratamento de enxaqueca e cefaléia tensional (17,18). Em uma revisão, foi proposto que como a etiologia de cefaléia tensional, CCG e enxaqueca são diferentes, as técnicas manuais deveriam ser diferentes (18), ainda que sto não tenha sido investigado. Ao revisar estes dados, o leitor tem que levar em conta a falta relativa e o baixo nível de evidência disponível (19). Há uma necessidade contínua por estudos randomizados controlado de alta qualidade que investigam a efetividade de terapias manuais para o manejo da dor de cabeça antes que seja possível formar conclusões firmes.
Um dos desafios diagnósticos comuns em avaliação da dor de cabeça é distinguir a CCG de outras formas de dor de cabeça (20,21). Realmente, estudos mostraram que um diagnóstico incorreto de dor de cabeça pode acontecer em mais que 50% de casos (22). O diagnóstico está essencialmente baseado nos sintomas apresentandos, junto com os achados (23) do exame físico clínico. A semelhanças de sinais e sintomas entre o muitos tipos de dor de cabeça (24) contribuem indubitavelmente ao desafio de diferenciar entre algumas formas de dor de cabeça, enquanto as formas com características únicas são identificadas mais facilmente.
EXAME
Exame subjetivo
É de preocupação primária excluir patologia séria ou mortal como tumores cranianos, meningites, arterite de célula gigantesca, hemorragia sub-aracnoídea, dissecação de artéria vertebral ou artéria carótida, entre outros. Embora estes são relativamente raros (25), o clínico dev estar atento para características históricas ou "bandeiras vermelhas" sugestivas de tal desordem. "Bandeiras vermelhas" incluem (1) começo súbito de um novo episódio de dor de cabeça severa; (2) um padrão de agravo de uma dor de cabeça préexistente na ausência de fatores predisponente óbvios; (3) dor de cabeça associada com febre, rigidez cervical, erupção cutânea de pele, e com uma história de câncer, AIDS ou outra doença sistêmica; (4) dor de cabeça associada com sinais focais neurológicos diferentes de aura típica; dor de cabeça (5) moderada ou severa disparada por tosse, esforço ou ao se abaixar; e (6) inicio de uma nova dor de cabeça durante ou depois da gravidez (26). Deve se referir os pacientes com uma ou mais bandeiras vermelhas para uma consulta médica imediata e investigação adicional.
Algumas dores de cabeça são fáceis de se diferenciar da CCG devido às características subjetivas distintivas delas. Por exemplo, dores de cabeça em salva, hemicrania paroxísmica e outros cefaléias autonômicas trigeminais apresentamtipicamente com dor de cabeça severa unilateral mas de pouca duração. De acordo com a IHS (5), a duração de dor de cabeça pode ser tão curta quanto 2 minutos com uma freqüência de 5 por dia para a hemicrania paroxísmica. Tipicamente, a dor é associada com características autonômicas como irritação ocular, enchimento nasal, sudorese facial e ptose. Levado como um todo, estas características não são consistentes com a CCG e pacientes que se apresentam com tais sintomas deveria buscar consulta médica, já que os mesmos de responder a terapia manual.
Enxaqueca com aura também tem sintomas (27) distintivos, como luzes que piscam ou manchas no campo de visão, diminuição da sensibilidade ou formigamento tudo os quais são completamente reversíveis durando menos de 60 minutos. As características típicas da enxaqueca sem aura incluem dor local unilateral, pulsante, intensidade moderada ou severa, durando um período de tempo fixo de 24 a 72 horas, agravado por atividade física rotineira como subir escada e associado com a náusea, fotofobia ou fonofobia (5).
As características de cefaléia tensional crônica incluem dor de cabeça que dura de 30 minutos a 7 dias,com sensção de pressão, intensidade leve a moderada, bilateral e nenhuma piora pela atividade física. Além disso, não deve haver nenhuma característica associada de náusea, vômito, fotofobia ou phonophobia (5).
O perfil de sofredores de CCG varia de acordo com a população de estudo. Estudos feitos em hospital revelam uma preponderância feminina entre 85 a 88% (8,28); em contraste, um amplo estudo realizado na comunidade revelou uma preponderância masculina de 71% (8). Esta diferença foi explicada pela relutância de homens em buscar tratamento. A idade média de inicio foi informada como ser entre 33 a 43 anos e uma duração média de sintomas entre 7 a 17 anos (78). A cronicidade parece desenvolver através de freqüência crescente de ataques de dor de cabeça duradouros, ao contrário de dores contínuas.
As características da CCG de acordo com o Cervicogenic Headache International Study Group (23,29) são da maior para a menor importância: I) Sinais e sintomas de involvimento cervical; II) Bloqueio diagnóstico positivo; III) Cefaléia unilateral sem mudança de lado; IV) Dor não pulsante, moderada a severa, geralmente se iniciando na nuca de duração variada; V) Efeito nulo ou marginal com indometacin, triptanos ou ergotaminas; VI) Afeitos pequenos e infrequentes associados ao ataque como nause, foto e fonofobia. Infelizmente, várias características desta dor de cabeça são compartilhadas entre outras formas de dor de cabeça, com exceção da presença de dor não-pulsante que normalmente começa no pescoço, com episódios de duração variada (23).
Levado como um todo, a informação do exame subjetivo deveria apontar para o possível envolvimento do coluna cervical na patogênese da dor de cabeça e um exame físico adicional é exigido para confirmar o diagnóstico.
EXAME FÍSICO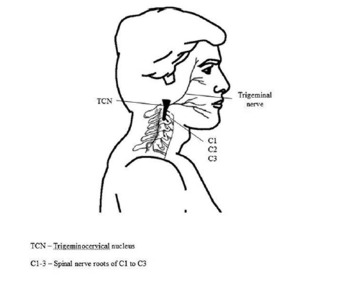
Embora até 70% dos indivíduos com dor de cabeça intermitente freqüente relatam dor cervical acompanhada (36,37), se pensa que menos de 18% são sintomas de patologia cervical (38). Uma explicação para isto pode ser a convergência de informação aferente dos aferentes trigeminais sensibilizados com os três nervos cervicais no núcleo trigeminocervical (39). Deste modo, a dor que vem do pescoço é percebida como na cabeça/face. Por conseguinte, o exame físico da cervical é um componente crítico no diagnóstico diferencial (23,35,40-42). Critérios de exames físicos incluem evdências clínicas, laboratóriais, e/ou imaginológicos de uma desordem dentro da coluna cervical ou nos tecidos moles do pescoço conhecidos por serem uma causa válida de dor de cabeça. Na ausência disto, deve haver evidência que a dor de cabeça pode ser atribuída à desordem cervical baseado em sinais clínicos que implicam uma fonte de dor no pescoço ou a abolição da dor de cabeça por bloqueio diagnóstico (injeção lenitiva) de uma estrutura cervical ou sua inervação (5). Essencialmente, qualquer estrutura que é inervada pelos três nervos cervicais superiores é uma fonte potencial de dor de cabeça. Conseqüentemente, o exame clínico tem que abarcar as estuturas articulares, neurais e miofasciais como mostradas na Figura acima.
Sistema articular
O Grupo de Estudo Internacional para a CCG considera que amplitude de movimento restringida do pescoço é um dos critérios diagnóstico principais para a CCG (29). Uns (40,42,43) mas não todos os (44,45) estudos relataram uma diminuição da ADM cervical em sujeitos com CCG, sendo a perda principal a limitação de movimento ativo no palno sagital, em particular extensão. Porém, outros estudos não acharam nenhuma limitação (44,45).
Como previamente reportado, a CCG surge principalmente de disfunção musculoesqueltica nos três segmentos cervicais superiores (12). O exame manual tem alta sensibilidade e especificidade para descobrir a presença ou ausência de disfunção articular cervical em pacientes com dor cervical e dor de cabeça (46 – 48). Além disso, Zito et al (42) determinou que a presença de disfunção articular cervical superior medida através de exame manual, em comparação a medidas de postura, amplitude de movimento, cinestesia cervical e função muscular craniocervical (49), identificava melhor os sofredores de CCG. O termo exame manual incorpora testes de movimento intervertebral fisiológico passivos, como também movimento intervertebral acessório passivo como pressões póstero-anterior. A restrição de movimento e respostas sintomáticas indicam o segmento cervical disfuncional mais doloroso (46 -48). Porém, estes testes requerem um grau alto de habilidade por parte do terapeuta, e a confiança deles foi questionada (50). Foi sugerido entretanto que esta possa ser uma reflexão de métodos de pesquisa pobres em lugar de ser um teste impreciso (50). Mais recentemente, Jull et al (40) e Amiri et al (35) sugeriram o procedimento de exame manual só incluir o movimento intervertebral acessório usando a pressão póstero-anterior. A identificação de uma resposta de dor, em lugar de hiper ou hipomobilidade, simplifica a identificação da disfunção cervical, reduzindo assim a habilidade requerida. Porém, esta informação por si só não é suficiente para prover sensibilidade adequada e especificidade para identificar a CCG; são requeridas outras formas de avaliação (40).
O teste de flexão-rotação cervical (TFR) é um método objetivo de determinar a disfunção articular cervical superior que está mostrando promessa na identificação de pacientes com CCG. O TFR (veja figura ao lado) é uma forma simplificada de exame manual desenvolvida para identificar disfunções de C1/2 (51). Neste procedimento, a coluna cervical é completamente flexionada e deve permitir o movimento irrestrito a C1/2 que tem uma habilidade sem igual para rodar em qualquer posição cervical. Como movimento a outros segmentos cervicais é limitado por esta posição no final da ADM, o movimento é isolado ao segmento de C1/2.
A amplitude de rotação em flexão máxima é normalmente de 40 – 44 graus para cada lado (45,52). Em contraste, indivíduos com disfunção de C1/2 têm significativamente menos rotação (20,45,53,54). Quando administrado por terapeutas manuais altamente treinados, o TFR tem alta sensibilidade (91%) e especificidade (90%) diferenciando sujeitos com CCG de controles assintomáticos ou sujeitos com enxaqueca com aura (20). Dados do mesmo estudo demonstrou que uma amplitude limitada a 32 graus ou menos pode ser considerado positivo.
Sistema muscular
A disfunção muscular também foi identificada como uma característica importante da CCG (40,42,57,58). Foi sugerido que disfunção possa também incluir a perda de alinhamentopostural e controle neuromuscular como também fraqueza dos músculos, resistência e extensibilidade (59). Uma reflexão da importância do sistema muscular para a CCG é mostrada pela melhoria a longo prazo nos sintomas de dor de cabeça como resultado dos exercícios projetados para retreinar o sistema muscular em pacientes com CCG (15).
Postura é uma medida indireta do estado funcional do sistema neuromuscular. Enquanto um estudo anterior achou uma associação entre postura da cabeça protrusa e CCG (58) esta associação não foi substanciada por mais estudos recentes e a mudança postural não é uma característica única a sofredores de CCG (42,44,60).
Incapacidades na força muscular e resistência dos flexores cervicais profundos parecem ser um das características definíveis da CCG (42,57,58). Prejuízos semelhantes não estavam presentes na enxaqueca ou na cefaléia tensional (40). O teste de flexão craniocervical mede a ação indireta dos flexores cervicais profundos (61) e foi mostrado ter boa confiabilidade (57). Este teste é executado com o paciente deitado e exige o paciente que execute a flexão cervical superior em cinco fases de amplitudes crescentes, mantendo cada posição por até 10 segundos. A amplitude de flexão de coluna cervical superior está relacionada diretamente com a ativação dos flexores cervicais profundos como foi demonstrado (62) em controles assintomáticos usando a eletromiografia. Como não é possível apalpar os flexores cervicais profundos diretamente, é possível apalpar os músculos flexores superficiais que devem estar minimamente ativos durante este teste. Ums das características fundamentais que clinicamente identificam a disfunção dos flexores cervicais profundos é o aumento da atividade dos músculos flexores superficial durante o teste (62), como uma tentativa de ganhar amplitude de movimento.
Há vários relatórios de encurtamentos músculares (42,57,60,63) e pontos gatilho (64) associado a CCG. Foram implicados vários músculos, incluindo o trapézio superior, esternocleidomastoídeo, escalenos, elevador da escápula, músculos peitorais, extensores suboccipitais curtos. Em um estudo, o encurtamento muscular foi achado em 35% dos sujeitos com CCG comparados a só 17% para a enxaqueca e 16% para a cefaléia tensional (42); neste estudo, menhum músculo predominou. Um estudo anterior achou que o encurtamento predominou no músculo trapézio superior (57).
Uma alteração sensóriomotora foi implicada em desordens cervicais. Medidas clínicas de alteração sensóriomotora incluem sensação da posição articular cervical, estabilidade postural e controle oculomotor; estes foram descritos em outro artigo (65). Vertigem, dor cervical e dor de cabeça são características comuns de alteração sensóriomotora do coluna cervical (66). Porém, a alteração da sensação de posição articular ou cinestesia cervical se mostrou igual em sujeitos com enxaqueca, CCG ou cefaléia tensional (40).
Sistema neural
A IHS (5) reconhece uma variedade de desordens neurais que podem causar dor de cabeça. Estas podem ser classificados amplamente sob desordens do pescoço e neuralgias cranianas e podem ser incluídas, entre outras, neuralgia occipital, síndrome de pescoço-língua, neuralgia pós-herpética e neuralgia do trigêmio. A classificação de dor neuropática, baseado em etiologia como a neuralgia occipital, tem problemas inerentes já que a patologia de um nervo sempre nem sempre causa dor (67,68). Em contraste, foi proposto que a dor neuropática seja classificada de acordo com a dominância dos mecanismos patológicos (69). Desordens de dor relacionadas aos tecidos neurais foram classificadas (70) como ou 1) sensibilização do nervo periférico que exibe mecâno-sensibilidade do tronco neural aumentada; 2) denervação com déficit neurológico; ou 3) sensibilização central mostrando características positivas (parestesia, alodinia, disestesia, hiperalgesia e estímulo dor independente). Na coluna cervical superior, as desordens de denervação são relativamente raras comparado à região cervical inferior. Em parte isto está devido à diferença em anatomia geral, sem disco e a raíz nervosa / espinhal relativamente pequena, com espaço comparativamente mais livre no forâme intervertebral, na região cervical superior.
Em nossa experiência clínica, as desordens neurais mais prevalentes que causam cefaléia se apresentam com sensibilização de nervo periférica mas função neurológica normal. Sensibilização de nervo periférica pode ser avaliada de acordo com os princípios descritos por Elvey e Hall (71). Deve haver evidência de provocação de dor e limitação de movimento durante os testes de provocação do tecido neural que alongam as estruturas neurais cervicais superiores. Além disso, deve haver evidência de dor em palpação dos mesmos tecidos. Um teste importante neste respeito é flexão cervical superior que alonga os tecidos neuromeningeos na região cervical alta (72). Para que se distingua as respostas de dor de tecidos neurais perifericamente sensibilizados de articulações adjacentes e músculos, é importante se repetir o teste com os braços posicionados em abdução, ou os membros inferiores na posição do teste de elevação da perna extendida, a fim de aumentar a provocação mecânica e assim implicar o tecido neural.
Embora há alguma evidência de respostas alteradas a provocação de tecido neural em sujeitos com CCG quando comparados a enxaqueca (73), a presença de mecâno-sensibilidade aumentada do tecido neural em pacientes com CCG é relativamente rara, com uma incidência relatada entre 7 a 10% (42). Não obstante, é importante identificar estes pacientes já que eles normalmente respondem inadequadamente a mobilização articular ou ao retreinamento do controle de motor.
Conclusão
A dor de cabeça é uma reclamação muito comum, surgindo de uma variedade de causas diferentes, nem todas quais são amenas a intervenção por terapia manual. A chave para identificar os pacientes apropriados é interpretar informação de todos os aspectos do exame inclusive o subjetivo. Este artigo esboçou a considerável evidência atual que suporta a identificação de pacientes com CCG.
REFERENCES
1. Stovner L, Hagen K, Jensen R, et al. The global burden of headache: A documentation of headache prevalence and disability worldwide. Cephalalgia 2007;27:193–210.
2. Diener I. The impact of cervicogenic headache on patients attending a private physiotherapy practice in Cape Town. S Afr J Physiother 2001;57:35–39.
3. Lipton RB, Stewart WF. The epidemiology of migraine. Eur Neurol 1994;34 Suppl 2:6–11.
4. Hu H, Markson L, Lipton R, Stewart W, Berger M. Burden of migraine in the United States: Disability and economic costs. Arch Intern Med 1999;1:813–818.
5. International Headache Society. The International Classification of Headache Disorders. 2nd ed. Cephalalgia 2004;24Suppl 1:9–160.
6. Fishbain DA, Cutler R, Cole B, Rosomoff HL, Rosomoff RS. International Headache Society headache diagnostic patterns in pain facility patients. Clin J Pain 2001;17:78–93.
7. Haldeman S, Dagenais S. Cervicogenic headaches: A critical review. Spine J 2001; 1:31–46.
8. Sjaastad O, Bakketeig LS. Prevalence of cervicogenic headache: Vaga study of headache epidemiology. Acta Neurol Scand 2008;117:170–183.
9. van Suijlekom HA, Lame I, Stomp-van den Berg SG, Kessels AG, Weber WE. Quality of life of patients with cervicogenic headache:A comparison with control subjects and patients with migraine or tension-type headache. Headache 2003;43:1034–1041.
10. Buzzi M, Moskowitz M. The pathophysiology of migraine: Year 2005. J Headache Pain 2005;6:105–111.
11. Aurora SK, Barrodale PM, Tipton RL, Khodavirdi A. Brainstem dysfunction in chronic migraine as evidenced by neurophysiological and positron emission tomography studies. Headache 2007;47:996–1003; discussion 1004–1007.
12. Bogduk N. Headache and the neck. In Goadsby P & Silberstein S, eds. Headache. Melbourne, Australia: Butterworth-Heinemann, 1997.
13. Edmeads J. Disorders of the neck: Cervicogenic headache. In Silberstein SD, Lipton RB, & Dalessio DJ, eds. Wolff ‘s Headache and Other Head Pain. Oxford, UK: Oxford University Press, 2001.
14. Edeling J. Migraine and other chronic headaches: Preliminary report on experimental physical treatment. S Afr J Physiother 1974;30:2–3.
15. Jull G, Trott P, Potter H, et al. A randomized controlled trial of exercise and manipulative therapy for cervicogenic headache. Spine 2002;27:1835–1843.
16. Bronfort G, Nilsson N, Haas M, et al. Noninvasive physical treatments for chronic/recurrent headache. Cochrane Database Syst Rev 2004(3):CD001878.
17. Biondi DM. Physical treatments for headache: A structured review. Headache 2005; 45:738–746.
18. Fernandez-de-Las-Penas C, Alonso-Blanco C, Cuadrado ML, Miangolarra JC, Barriga FJ, Pareja JA. Are manual therapies eff ective in reducing pain from tension-type headache? A systematic review. Clin J Pain 2006;22:278–285.
19. Fernandez-des-las-Penas C, Alonos-Blanco C, San-Roman J, Miangolarra-Page J. Methodological
quality or randomized controlled trials of spinal manipulation and mobilisation in tension-type headache, migraine, and cervicogenic headache. J Orthop Sports Phys Ther 2006;36:160–169.
20. Ogince M, Hall T, Robinson K. Th e diagnostic validity of the cervical fl exion-rotation test in C1/2-related cervicogenic headache. Man Th er 2007;12:256–262.
21. Sjaastad O, Bovim G. Cervicogenic headache: Th e diff erentiation from common migraine. An overview. Funct Neurol 1991; 6:93–100.
22. Pfaff enrath V, Kaube H. Diagnostics of cervicogenic headache. Funct Neurol 1990; 5:159–164.
23. Sjaastad O, Fredriksen TA, Pfaff enrath V. Cervicogenic headache: Diagnostic criteria. Th e Cervicogenic Headache International Study Group. Headache 1998;38:442–445.
24. Nicholson GG, Gaston J. Cervical headache. J Orthop Sports Phys Th er 2001;31:184–193.
25. Landtblom AM, Fridriksson S, Boivie J, Hillman J, Johansson G, Johansson I. Sudden onset headache: A prospective study of features, incidence and causes. Cephalalgia 2002;22:354–360.
26. Bigal ME, Lipton RB. Th e diff erential diagnosis of chronic daily headaches: An algorithm-based approach. J Headache Pain 2007;8:DOI 10.1007/s10194–007–0418–3.
27. Kirchmann M. Migraine with aura: New understanding from clinical epidemiologic studies. Curr Opin Neurol 2006;19:286–293.
28. Vincent MB, Luna RA. Cervicogenic headache:A comparison with migraine and tension-type headache. Cephalalgia 1999;19Suppl 25:11–16.
29. Sjaastad O, Fredriksen TA, Pfaff enrath V.Cervicogenic headache: Diagnostic criteria. Headache 1990;30:725–726.
30. Antonaci F, Ghirmai S, Bono G, Sandrini G,Nappi G. Cervicogenic headache: Evaluation of the original diagnostic criteria. Cephalalgia 2001;21:573–583.
31. Vincent M. Validation of criteria for cervicogenic headache. Funct Neurol 1998;13:74–75.
32. Antonaci F, Bono G, Chimento P. Diagnosing cervicogenic headache. J Headache Pain 2006;7:145–148.
33. Jansen J, Sjaastad O. Cervicogenic headache: Smith/Robinson approach in bilateral cases. Funct Neurol 2006;21:205–210.
34. Sjaastad O, Bakketeig LS. Migraine without aura: Comparison with cervicogenic headache. Vaga study of headache epidemiology. Acta Neurol Scand 2007:PMID:18031560.
35. Amiri M, Jull G, Bullock-Saxton J, Darnell R, Lander C. Cervical musculoskeletal impairment in frequent intermittent headache. Part 2: Subjects with concurrent headache types. Cephalalgia 2007;27:891–898.
36. Blau J, MacGregor E. Migraine and the neck. Headache 1994;34:88–90.
37. Henry P, Dartigues J, Puymirat C, Peytour P, Lucas J. Th e association cervicalgiaheadaches: An epidemiologic study. Cephalalgia 1987;7(Suppl 6):189–190.
38. Nilsson N. The prevalence of cervicogenic headache in a random population sample of 20–59-year-olds. Spine 1995;20:1884–1888.
39. Bogduk N. Cervicogenic headache: Anatomical basis and pathophysiological mechanisms. Journal of Current Pain Headache Report 2001;5:382–386.
40. Jull G, Amiri M, Bullock-Saxton J, Darnell R, Lander C. Cervical musculoskeletal impairment in frequent intermittent headache. Part 1: Subjects with single headaches. Cephalalgia 2007;27:793–802.
41. Sjaastad O, Fredriksen T, Pareja J, Stolt-Nielsen A, Vincent M. Co-existence of cervicogenic headache and migraine without aura. Funct Neurol 1999;14:209–218.
42. Zito G, Jull G, Story I. Clinical tests of musculoskeletal dysfunction in the diagnosis of cervicogenic headache. Man Th er 2006;11:118–129.
43. Zwart JA. Neck mobility in diff erent headache disorders. Headache 1997;37:6–11.
44. Dumas JP, Arsenault AB, Boudreau G, et al. Physical impairments in cervicogenic headache:
Traumatic vs. non-traumatic onset. Cephalalgia 2001;21:884–893.
45. Hall T, Robinson K. The fl exion-rotation test and active cervical mobility: A comparative measurement study in cervicogenic headache. Man Ther 2004;9:197–202.
46. Sandmark H, Nisell R. Validity of fi ve common manual neck pain provocation tests. Scand J Rehabil Med 1995;27:131–136.
47. Jull G, Bogduk N, Marsland A. Th e accuracy of manual diagnosis for cervical zygapophyseal
joint pain syndromes. Med J Aust 1988;148:233–236.
48. Jull G, Zito G, Trott P, Potter H, Shirley D, Richardson C. Inter-examiner reliability to detect painful upper cervical joint dysfunction. Aust J Physiother 1997;43:125–129.
49. Maitland G, Hengeveld E, Banks K, English K. Maitland’s Vertebral Manipulation. 6th ed. London, UK: Butterworth Heinemann, 2001.
50. Stochkendahl M, Christensen H, Hartvigsen J, et al. Manual examination of the spine: A systematic review of reproducibility. J Manipulative & Physiol Th er 2006;29:475–485.
51. Dvorak J, Herdmann J, Janssen B, Th eiler R, Grob D. Motor-evoked potentials in patients with cervical spine disorders. Spine 1990; 15:1013–1016.
52. Amiri M, Jull G, Bullock-Saxton J. Measuring range of active cervical rotation in a position of full head fl exion using the 3D Fastrak measurement system: An intra-tester reliability study. Man Th er 2003;8:176–179
53. Dvorak J, Antinnes JA, Panjabi M, Loustalot D, Bonomo M. Age- and gender-related normal motion of the cervical spine. Spine 1992;17(Suppl 10):393–398.
54. Hall T, Robinson K, Fujinawa O, Kiyokazu A. The infl uence of examiner experience on interpretation of the cervical fl exion-rotation test. 15th International World Confederation for Physical Th erapy. Vancouver; 2007.
55. Hall T, Robinson K, Fujinawa O, Kiyokazu A. Inter-tester reliability and diagnostic validity of the cervical flexion-rotation test in cervicogenic headache. J Manipulative & Physiol Th er 2007; Accepted for publication.
56. Smith K, Hall T, Robinson K. The influence of age, gender, lifestyle factors and sub-clinical neck pain on cervical range of motion. Man Ther 2007;DOI:10.1016/j.math.2007.07.005.
57. Jull G, Barrett C, Magee R, Ho P. Further clinical clarifi cation of the muscle dysfunction in cervical headache. Cephalalgia 1999;19:179–185.
58. Watson DH, Trott PH. Cervical headache: An investigation of natural head posture and upper cervical fl exor muscle performance. Cephalalgia 1993;13:272–284; discussion 232.
59. Jull G, Niere K. Th e cervical spine and headache. In Boyling G & Jull G, eds. Grieve’s Modern Manual Th erapy. London, UK: Churchill Livingstone, 2004.
60. Treleaven J, Jull G, Atkinson L. Cervical musculoskeletal dysfunction in post-concussional headache. Cephalalgia 1994;14: 273–279.
61. Falla D. Unravelling the complexity of muscle impairment in chronic neck pain. Man Thr 2004;9:125–133.
62. Falla DL, Jull GA, Hodges PW. Patients with neck pain demonstrate reduced electromyographic
activity of the deep cervical flexormuscles during performance of the craniocervical flxion test. Spine 2004;29:2108– 2114.
63. McDonnell M, Sahrmann S, Van Dillen L. A specifi c exercise program and modifi cation of postural alignment for the treatment of cervicogenic headache: A case report. J Orthop Sports Phys Th er 2005;35:3–15.
64. Roth JK, Roth RS, Weintraub JR, Simons DG. Cervicogenic headache caused by myofascial trigger points in the sternocleidomastoid: A case report. Cephalalgia 2007; 27:375–380.
65. Treleaven J. Sensorimotor disturbances in neck disorders aff ecting postural stability, head and eye movement control. Man Ther 2007;DOI:10.1016/j.math.2007.06.003.
66. Reid S, Rivett D, Callister R, Katekar M. Sustained natural apophyseal glides (SNAGS) are an effective treatment for cervicogenic dizziness. Man Th er 2007;DOI:10.1016/j. math.2007.03.006.
67. Beattie P, Meyers S, Stratford P, Millard R,Hollenberg G. Associations between patient report of symptoms and anatomic impairment visible on lumbar magnetic resonance imaging. Spine 2001;25:819–828.
68. Boden S, Davis D, Dina T, Patronas N, Wiesel S. Abnormal magnetic-resonance scans of the lumbar spine in asymptomatic subjects: A prospective investigation. Journal of Bone and Joint Surgery 1990;72:403–408.
69. Backonja MM. Defi ning neuropathic pain. Anesth Analg 2003;97:785–790.
70. Schafer A, Hall TM, Briff a K. Classification of low back-related leg pain: A proposed pathomechanism-based approach. Man
Th er 2007;DOI:10.1016/j.math.2007.10.003. 71. Elvey R, Hall T. Neural tissue evaluation and treatment. In Donatelli R, ed. Physical Therapy of the Shoulder. New York: Churchill Livingstone, 1997.
72. Hall TM, Elvey RL. Management of mechano-sensitivity of the nervous system in spinal pain syndromes. In Boyling G & Jull G, eds. Grieve’s Modern Manual Therapy. London, UK: Churchill Livingstone, 2004.
73. von Piekartz HJ, Schouten S, Aufdemkampe G. Neurodynamic responses in children with migraine or cervicogenic headache versus a control group: A comparative study. Man Ther 2007;12:153–160.
74. Jull GA, Stanton WR. Predictors of responsiveness to physiotherapy management of cervicogenic headache. Cephalalgia 2005;25: 101–108.
|
|



|